I) Clausius (1822-1888): non è possibile che il calore fluisca spontaneamente da temperature più basse a temperature più alte.
Nota: è possibile che il calore fluisca da un corpo freddo ad uno caldo (come in un frigo) ma ciò non può accadere spontaneamente.
II) Kelvin (1824-1907): non è possibile realizzare una macchina termica ciclica che trasformi il calore integralmente in lavoro.
Nota: il calore può trasformarsi integralmente in lavoro (ad esempio in una trasformazione isoterma) ma mai in una trasformazione ciclica.
Ricordiamo per inciso che con macchina termica si intende un dispositivo che opera tra due temperature e converte calore in lavoro in modo ciclico, producendo cioè ogni volta una certa quantità di lavoro (vedi Wikipedia).
Esiste una terza importante formulazione equivalente del secondo principio della termodinamica (che abbiamo già descritto nel post "Entropia: una grandezza anomala!") che afferma:
III) Clausius: in un sistema isolato e per una trasformazione irreversibile l'entropia tende sempre ad aumentare.
Si sa che l'entropia S è una funzione che dipende dallo stato termodinamico in cui si trova il sistema; se cioè un sistema passa dallo stato A a quello B in modo reversibile avremo per la sua variazione di entropia ∆S:
∆S=∫ABdS=SB-SA
dove dS=δQrev/T è per definizione l'entropia infinitesima e dove Qrev è la quantità di calore assorbito o ceduto in maniera reversibile e isoterma dal sistema a temperatura T.Nota: per chiarimenti sulla definizione di entropia vedi il post "Entropia: una grandezza anomala!".
Poiché S è una funzione di stato possiamo considerare, come seconda variabile del sistema, la temperatura T per descrivere una qualsiasi trasformazione reversibile di un gas ideale; utilizzeremo quindi il piano cartesiano T-S di Gibbs (diagramma entropico) invece del noto piano di Clapeyron p-V per tracciare il grafico della trasformazione.
Nota: poiché l'equazione dei gas ideali è pV=nRT fissato il numero di moli n possiamo in generale descrivere il sistema con due sole variabili di stato.
Si noti che sul diagramma T-S una trasformazione isoterma (cioè T=costante) è descritta da una linea orizzontale, mentre una adiabatica (cioè Q=0) è rappresentata da una linea verticale (essendo S=costante).
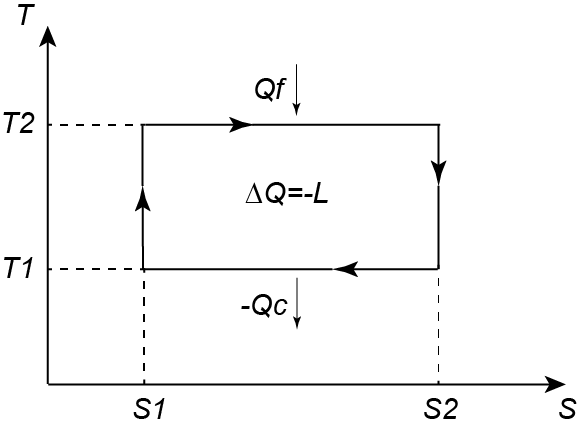
Se ad esempio consideriamo un ciclo formato da due trasformazioni isoterme e due adiabatiche (alternate in sequenza) avremo un motore termico reversibile che trasforma calore in lavoro, meglio noto come ciclo di Carnot, descritto nel piano entropico T-S da una linea rettangolare:
È immediato calcolare il calore assorbito o ceduto reversibilmente nelle due trasformazioni isoterme (posto T2>T1 e S2>S1); avremo rispettivamente seguendo il diagramma (e ricordando che δQrev=TdS):
Qf=∫S1S2TdS=T2(S2-S1) e -Qc=∫S2S1TdS=T1(S1-S2)
dove per definizione Qf è il calore fornito al sistema mentre -Qc è quello ceduto all'ambiente dal sistema.(Qui puoi vedere un video di Rai Scuola che mostra bene il ciclo di Carnot!)
Inoltre poiché la variazione di energia interna ∆U è nulla alla fine del ciclo (essendo U una funzione di stato), il lavoro svolto dalla macchina sull'ambiente durante la trasformazione ciclica è -L=Q (essendo per il Primo principio della termodinamica ∆U=L+Q) e quindi si ha:
-L=Qf-Qc=T2(S2-S1)+T1(S1-S2)=(T2-T1)(S2-S1)
essendo per definizione -L il lavoro fatto dal sistema e Q=Qf-Qc il calore totale fornito al sistema (essendo Qf>Qc risulta -L>0).
Nota: si osservi che l'area del rettangolo (T2-T1)(S2-S1) rappresenta proprio il calore Q scambiato durante la trasformazione.
Se ricordiamo che il rendimento di una macchina termica (o meglio l'efficienza di conversione calore/lavoro) è così definito:
ηrev=-L/Qf=(Qf-Qc)/Qf=1-Qc/Qf
allora inserendo i valori di -Qc e Qf prima ricavati si ha:
ηrev=1-Qc/Qf=1+T1(S1-S2)/T2(S2-S1)=1-T1/T2
da cui segue un risultato fondamentale del ciclo reversibile di Carnot*:
Qf/T2-Qc/T1=0.
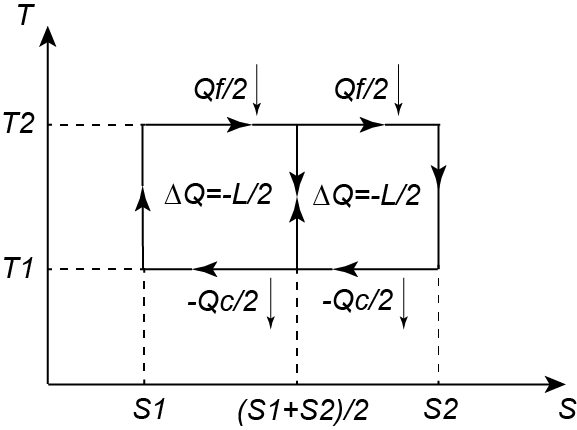
Nota: si noti che se T1=T2 segue ηrev=0 cioè senza una differenza di temperatura ∆T non si può ottenere lavoro da una macchina termica.Al fine di generalizzare questo risultato per qualsiasi ciclo termodinamico, dividiamo in due cicli di Carnot quello precedente, come mostrato in figura:
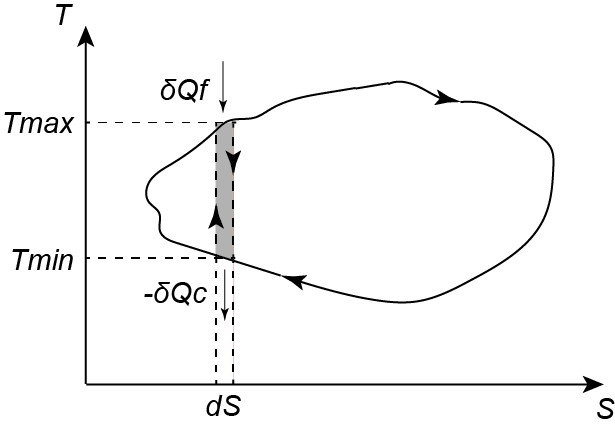
Per estensione se consideriamo un qualsiasi ciclo termodinamico, la curva del diagramma T-S potrà essere approssimata quanto si vuole da un insieme infinito di cicli di Carnot (rappresentati da rettangolini di larghezza infinitesima dS), compresi tra le rispettive temperature dell'estremità superiore Tmax e inferiore Tmin come mostrato in figura:
Perciò, come già visto sopra, per ogni rettangolo di larghezza infinitesima dS e altezza compresa tra Tmax e Tmin possiamo scrivere per gli incrementi infinitesimi di calore:
δQf/Tmax-δQc/Tmin=0
e sommando su tutti gli infiniti rettangoli:
∫cicloδQrev/T=0
tale relazione è valida per qualsiasi ciclo termodinamico reversibile.
Nota: lo stesso risultato si può ottenere su un diagramma p-V dove però i cicli di Carnot non sono rappresentati da un semplice rettangolo.
Infine per estendere questo risultato notevole anche ai cicli irreversibili, enunciamo un precedente risultato** ottenuto da Carnot (vedi Wikipedia) anch'esso equivalente al secondo principio della termodinamica:
IV) Carnot (1796-1832): il rendimento di una macchina termica irreversibile che lavora tra due temperature, è sempre minore del rendimento ηrev di una macchina equivalente ma reversibile: ηirr<ηrev.
Nota: si dimostra che il rendimento di tutte le macchine reversibili che lavorano tra T1 e T2 è lo stesso.
Quindi essendo ηrev=1-Qc/Qf allora a parità di condizioni il calore ceduto -Qc in un ciclo irreversibile, sarà maggiore (in valore assoluto) del caso reversibile (poiché deve risultare ηirr<ηrev).
Ciò significa che per ogni rettangolo infinitesimo del diagramma prima definito, ma per un ciclo irreversibile, si ha:
Nota: per approfondire questa relazione vedi il post "Entropia: una grandezza anomala!".
(*) Se definiamo l'energia non più utilizzabile o degradata come Ed=Lf-L dove Lf=Qf=T2∆S è il lavoro fatto dalla macchina a T2 costante (isoterma) e L=(1-T1/T2 )Qf è quello a fine ciclo allora Ed=T2∆S-T2∆S+T1∆S=T1∆S cioè l'energia degradata è proporzionale all'aumento di entropia(!) con Ed=-Qc.
(**) Questo risultato è stato ottenuto da Carnot nel 1824 cioè prima (per motivi anagrafici) che Clausius e Kelvin enunciassero il secondo principio (da cui però viene solitamente derivato il teorema di Carnot!).
Infine per estendere questo risultato notevole anche ai cicli irreversibili, enunciamo un precedente risultato** ottenuto da Carnot (vedi Wikipedia) anch'esso equivalente al secondo principio della termodinamica:
IV) Carnot (1796-1832): il rendimento di una macchina termica irreversibile che lavora tra due temperature, è sempre minore del rendimento ηrev di una macchina equivalente ma reversibile: ηirr<ηrev.
Nota: si dimostra che il rendimento di tutte le macchine reversibili che lavorano tra T1 e T2 è lo stesso.
Quindi essendo ηrev=1-Qc/Qf allora a parità di condizioni il calore ceduto -Qc in un ciclo irreversibile, sarà maggiore (in valore assoluto) del caso reversibile (poiché deve risultare ηirr<ηrev).
Ciò significa che per ogni rettangolo infinitesimo del diagramma prima definito, ma per un ciclo irreversibile, si ha:
δQf/Tmax-δQc/Tmin<0
e perciò in generale per un qualsiasi ciclo irreversibile:
∫cicloδQirr/T<0
che è la famosa diseguaglianza di Clausius***. Nota: per approfondire questa relazione vedi il post "Entropia: una grandezza anomala!".
(*) Se definiamo l'energia non più utilizzabile o degradata come Ed=Lf-L dove Lf=Qf=T2∆S è il lavoro fatto dalla macchina a T2 costante (isoterma) e L=(1-T1/T2 )Qf è quello a fine ciclo allora Ed=T2∆S-T2∆S+T1∆S=T1∆S cioè l'energia degradata è proporzionale all'aumento di entropia(!) con Ed=-Qc.
(**) Questo risultato è stato ottenuto da Carnot nel 1824 cioè prima (per motivi anagrafici) che Clausius e Kelvin enunciassero il secondo principio (da cui però viene solitamente derivato il teorema di Carnot!).
(***) Si può derivare la diseguaglianza di Clausius partendo in modo indifferente da uno qualsiasi degli enunciati I->IV sopra esposti (dato che se ne può dimostrare l'equivalenza).
Nessun commento:
Posta un commento